par Prof. Dr. Paul Berth (1) et Prof. Dr. Alain Préat (2)
1. Faculté des Sciences, Université Européenne
2. Faculté des Sciences, Université Libre de Bruxelles
Article initialement publié le 4 mars sur le site Science, climat et énergie.
(Lire également l’article publié sur ce site le 13 avril 2017 intitulé L’acidification des océans : causes anthropiques versus variabilité naturelle)
L’ajout de quantités importantes de CO2 dans l’océan ne peut que légèrement ‘acidifier’ l’océan, en provoquant une diminution du pH sans pour autant rendre l’océan ‘acide’. Pour que les effets de dissolution ‘acide’ puissent avoir lieu, par exemple sur les coquilles ou tests de la plupart des invertébrés marins, le pH doit être inférieur à 7,0. Or aujourd’hui on en est loin, la valeur étant de 8,1 alors qu’elle était probablement de 8,25 en 1750.
Pourtant les médias et de nombreux scientifiques n’hésitent pas à grossir le trait, annonçant quasi-quotidiennement les pires scénarios pour l’effondrement des écosystèmes et la perte irrémédiable de la biodiversité. Cette exagération, le plus souvent (mais pas toujours !) inconsciente, fait partie de l’Effet de Déclin, inhérent à la méthode scientifique (par exemple ici).
Qu’en est-il finalement de l’acidification : alarmisme ou non ? Nous allons constater que cet alarmisme, surtout médiatique, n’est pas justifié concernant les poissons et a été alimenté par une dérive bien connue de l’approche scientifique liée à ce que l’on appelle l’Effet de Déclin. Cet effet, qui sévit également dans les sciences sociales et les sciences psychologiques, a également frappé les sciences biologiques lorsque les relations entre les organismes marins et l‘acidification furent étudiées il y a environ 15 ans.
1.Introduction
Le thème de l’acidification a déjà été abordé par SCE : rappelons d’entrée de jeu que les mesures directes de pH sont récentes et nous n’avons aucun recul historique suffisant. Selon les médias et les ONG écologistes, qui se basent sur le GIEC et sur certaines publications (e.g., Caldeira & Wickett 2003), le pH des océans aurait été de 8,25 en 1750. Cependant, il faut savoir que personne n’a jamais mesuré le pH des océans en 1750, puisque le concept de pH n’a été inventé qu’en 1909 (par le danois Søren P.L. Sørensen), et que les premiers appareils fiables pour mesurer le pH ne sont apparus qu’en 1924… ! Nous ne sommes donc pas certains de cette valeur de 8,25 pour 1750… La valeur de 8,25 est en fait obtenue par des mesures indirectes, par calcul, et n’est donc pas certaine. De plus, à l’heure d’aujourd’hui, tous les pH sont possibles dans l’océan. Lorsqu’on dit que les océans actuels sont à un pH de 8,1, de quel océan parle-t-on? S’agit-il du pH moyen global? Si c’est de cela dont on parle, quelle est l’incertitude sur la mesure? (i.e., l’écart-type?). Ceci n’est jamais indiqué! Il faut savoir que si l’on prend un jour de la semaine, tous les pH sont possibles dans les océans, comme l’illustre très bien la figure suivante (Figure 1) :
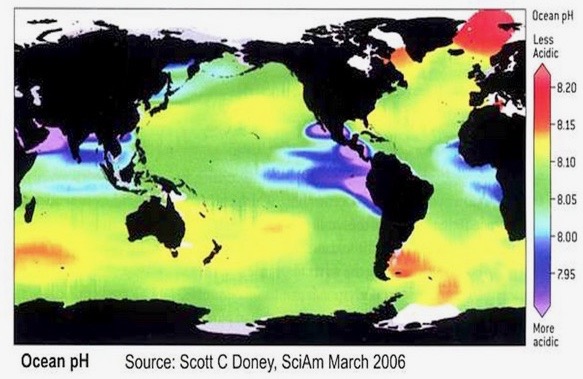
Ces incertitudes concernant le pH sont l’un des fondements à l’origine de l’article de J. Clements et al. (2022) (in PLOS Biology) consacré à l’Effet de Déclin et aux variations éventuelles du comportement des poissons récifaux attribuée à l’acidification. Malgré l’absence d’expériences d’acidification sur le comportement de nombreux poissons, une généralisation est faite et le tout est relayé tel quel dans la littérature scientifique, souvent même dans des revues à fort impact et les médias. Pour Clements et al. (2022), les conclusions des études rapportées dans la littérature scientifique sont simplement fausses ou très fortement exagérées, suite à l’absence d’expériences sur le sujet et à des échantillonnages de populations très faibles.
Cette dérive ou ‘précipitation’ dans l’interprétation des données fait partie de la notion d’Effet de Déclin (décrit pour la première fois en 1930 par Rhines, voir également Schooler, 2011), et définie par Peter Ridd comme ceci :
‘This problem with exaggeration of threats applies to many areas of science and has a name: The Decline Effect. The Decline Effect goes like this: an early report, usually attracting huge media interest, predicts some sort of catastrophe. But when follow up work is done, usually with far better experimental procedure and far greater numbers of samples, the original report turns out to be wrong’.
[Taduction : Ce problème d’exagération des menaces s’applique à de nombreux domaines scientifiques et porte un nom : l’effet de déclin. L’effet de déclin peut s’énoncer comme suit : un premier rapport, qui suscite généralement un énorme intérêt médiatique, prédit une sorte de catastrophe. Mais lorsque le travail de suivi est effectué, généralement avec une bien meilleure procédure expérimentale et un bien plus grand nombre d’échantillons, le rapport original s’avère erroné.]
Un exemple très clair nous est fourni avec certaines études menées à la Grande Barrière Récifale d’Australie (nombreuses références dont Anderson et al. (2015) et Marhohasy et Abbot (2018)). Ces études démontrent que les stades larvaires des coraux ne sont en fait pas affectés par une diminution du pH, ni par une augmentation du CO2 ou d’une combinaison avec la température. D’autres organismes marins calcifiants (mollusques, crabes) ou non (poissons clowns, algues) associés à la Grand Barrière ont également été étudiés in situ et montrent une faculté d’adaptation à une diminution du pH, avec souvent même un renforcement de la calcification (mollusques), un accroissement de leur productivité (algues) ou de la reproduction (poissons clowns). Ces résultats vont donc à l’encontre des expériences de laboratoire, qui portent généralement sur un seule espèce, hors de tout écosystème naturel, pendant un temps court, et qui ne permettent pas de considérer le potentiel réel d’adaptation dans le milieu naturel, ni les nombreux cycles agissant continuellement dans le milieu marin.
Revenons à l’étude de J. Clements et al. (2022). Plus de 300 articles par année, en progression exponentielle depuis 2006, sont consacrés aux impacts potentiels de l’acidification océanique. Parmi ceux-ci, Kroeker et al. (2010) estiment que cette acidification a généralement d’importants effets négatifs sur les organismes, à tempérer (selon ces auteurs) par la sensibilité des différentes espèces marines. De nombreux autres articles dans des revues de haut rang (réf. dans Clements et al. 2022) concluent que l’effet de l’acidification a de fortes conséquences sur le comportement des poissons entrainant des conséquences écologiques négatives.
Ces résultats, basés sur des travaux de laboratoire furent médiatisés à outrance jusqu’à être présentés à la Maison Blanche (Roberts, 2015). Ainsi face à cet alarmisme qui ne souffrait d’aucune doute, bien que les résultats s’appuient sur des expériences effectuées en dehors du milieu naturel, plusieurs millions de dollars furent injectés par des instances internationales afin de quantifier les impacts de l’acidification sur le comportement des organismes marins.
Cependant, de nombreux articles ont ensuite mis en cause cet alarmisme et la fiabilité des premières études consacrées à l’acidification. Une des premières études ayant mis en doute ces résultats fut celle de Browman (2016) qui souligne notamment que les études qui montrent une absence d’effet ne sont généralement pas publiées (ou ne peuvent pas l’être), et surtout qu’encore aujourd’hui les mécanismes de calcification restent peu connus chez de nombreuses espèces. Même constat réalisé par Clark et al. (2020), pour qui le taux d’acidification actuel n’a que des effets négligeables sur les poissons récifaux. Ce sont ces points qui font l’objet de la discussion de Clements et al. (2022). Cet article montre que les effets initiaux de l’acidification sur le comportement des poissons ont pratiquement disparu au cours des cinq dernières années et que des biais courants influencent les résultats rapportés dans ce domaine. Les auteurs discutent ensuite des moyens d’atténuer ces biais.
2. Méthodes
Un effet de déclin se produit lorsque une première analyse semble révéler un effet majeur, mais lorsque des analyses plus tardives et souvent plus poussées révèlent qu’en fait nous avons un effet mineur, voir plus aucun effet.
Pour évaluer si un effet de déclin était présent ou non dans la littérature concernant l’effet de l’acidification sur le comportement des poissons, 4411 études sur le sujet ont été récupérées entre 2009 et 2018 en utilisant Scopus et Google Scholar. Les mots clés “ocean acidification fish behavio(u)r” et “elevated CO2 fish behavio(u)r » ont été utilisés. Au final, après analyse des publications, seulement 91 publications ont été retenues par les auteurs pour leur méta-analyse car beaucoup d’études ne comportaient pas de données quantitatives, étaient consacrées à des invertébrés, ou étaient des reviews. Beaucoup d’études apparaissaient également plusieurs fois dans les 4411 articles de départ. Ensuite, pour chaque publication retenue, les effets comportementaux observés sur des poissons placés dans de l’eau légèrement acidifiée (XE) ont été comparés aux effets comportementaux de poissons contrôles, placés dans de l’eau normale (XC). Un rapport est ensuite calculé de la manière suivante :
lnRR = ln(XE/XC)
Le rapport a été appelé RR par les auteurs de l’article (pour « Response Ratio »). Le logarithme népérien de ce rapport a ensuite été calculé (afin d’éviter de manipuler de trop grands ou de trop petits chiffres) et la valeur absolue a finalement été sélectionnée. Les résultats obtenus par les auteurs étaient donc toujours un chiffre positif compris entre 0 et 15. Les lnRR ont ensuite été présentés dans un graphique en fonction de l’année de publication. Il y a donc autant de points que d’études publiées sur le comportement des poissons.
Cependant, visualiser un effet éventuel d’acidification sur 10 poissons n’est pas la même chose que d’évaluer cet effet sur 100 poissons. Les études analysant un grand nombre d’individus offrent donc des résultats plus rigoureux et probablement plus proches de la réalité. Les auteurs ont donc également normalisé le lnRR avec les nombres de poissons considérés dans chacune des études.
3. Résultats
3.1. Processus biologiques
Sur la base d’une revue systématique de la littérature et d’une méta-analyse (n = 91 études), les preuves de l’Effet de Déclin dans les études de l’acidification des océans sur le comportement des poissons sont clairs (Figure 2 ci-dessous, = Fig 1a et 1b in Clements et al. 2022).
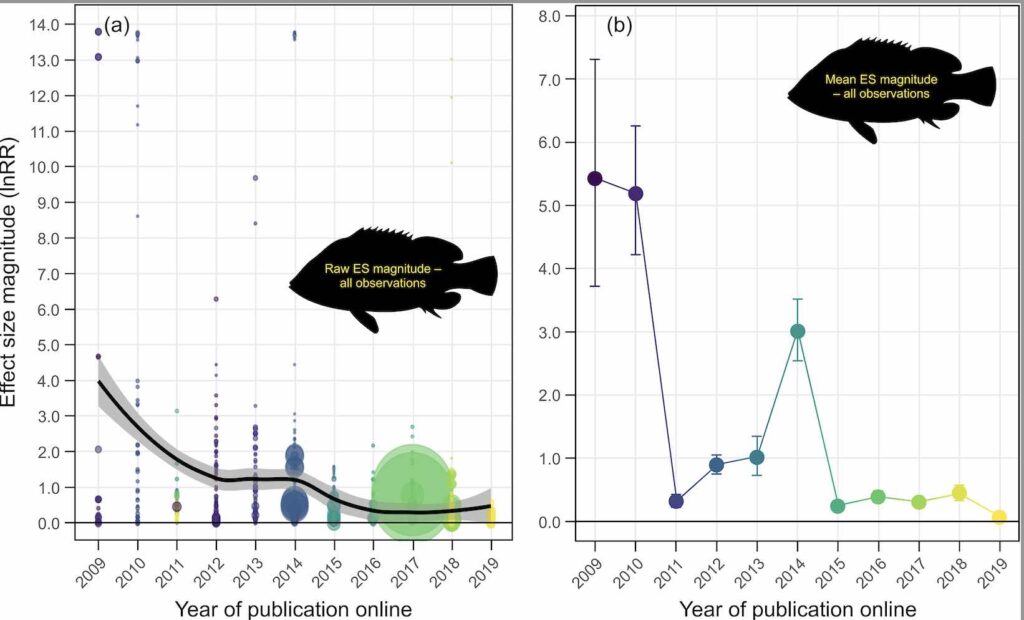
En considérant les mesures normalisées par la taille des échantillons (Figure 2b), nous pouvons voir que l’effet de l’acidification sur le comportement des poissons (lnRR) a diminué d’un ordre de grandeur au cours de la dernière décennie, passant d’une ampleur moyenne de >5 en 2009 et 2010 à une ampleur <0,5 après 2015 (Figure 1b). L’ampleur de la taille d’Effet moyenne était donc disproportionnée dans les premières études réalisées en 2009, a ensuite oscillé autour de tailles d’Effet modérées de 2012 à 2014, et a pratiquement disparu ces dernières années (Fig. 2a et 2b).
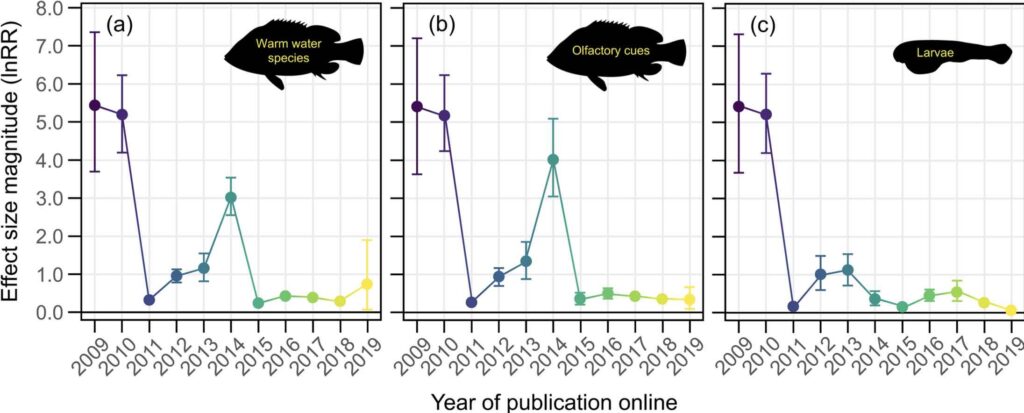
Les fortes amplitudes de l’Effet de Déclin des premières études sur l’acidification et le comportement des poissons ne sont pas présentes dans la majorité des études des cinq dernières années (Fig 2b ici et Tableau S1 in Clement et al. 2022). Cet Effet de Déclin pourrait s’expliquer par un certain nombre de facteurs, notamment biologiques. Par exemple, les poissons d’eau froide des régions tempérées connaissent un degré plus élevé de variabilité temporelle des paramètres de la chimie des carbonates sur de grandes zones spatiales (Kwiatkowski et Orr, 2018). Par conséquent, ils peuvent être moins sensibles aux changements du CO2 de l’eau de mer (Baumann, 2019). En conséquence, si un nombre croissant d’études sur les espèces d’eau froide au fil du temps était responsable de l’Effet de Déclin, la suppression des espèces d’eau froide de l’ensemble de données (en ne gardant plus que les seules espèces d’eau chaude) devrait entraîner la disparition de la tendance de l’Effet de Déclin. Mais les auteurs montrent que l’Effet de Déclin persiste lorsque seules les espèces d’eau chaude sont prises en compte (Fig. 3a). De même, les effets les plus marqués de l’acidification des océans sur le comportement des poissons ont sans aucun doute été rapportés pour leurs réponses aux signaux chimiques (ici « olfactifs »), et un nombre croissant d’études sur les comportements non olfactifs pourrait aussi expliquer l’Effet de Déclin. Encore une fois, si c’était vraiment le cas, la suppression des comportements non olfactifs de l’ensemble des données devrait annuler la tendance à l’Effet de Déclin. Là encore, ce n’est pas le cas (Fig. 3b). Enfin, les premières études sur l’acidification des océans et le comportement des poissons ont utilisé des larves, qui sont généralement considérées comme plus sensibles aux perturbations environnementales que les juvéniles et les adultes. Si une plus grande proportion d’études utilisait des stades de vie moins sensibles au fil du temps, alors le fait d’éliminer ces stades de vie et de se concentrer exclusivement sur les larves devrait abolir l’Effet de Déclin. Une fois de plus, ce n’est pas le cas (Fig. 3c). Ces analyses montrent donc que les études d’acidification des océans sur le comportement des poissons présentent un Effet de Déclin qui ne peut s’expliquer par les trois processus biologiques généralement considérés comme des moteurs importants des effets de l’acidification (Fig. 3a-3c in Clements et al. 2022, Tableau S1, in idem).
Il existe donc d’autres facteurs potentiels qui pourraient être à l’origine de l’Effet de Déclin, mais ils ne sont pas facilement testables à partir de la base de données de Clements et al. (2022). Citons l’influence de la variabilité du CO2 en comparant les espèces d’eau froide et d’eau chaude, difficile à tester car la plupart des études ne rapportent pas les niveaux réels de CO2 auxquels les animaux expérimentaux (et leurs ancêtres) ont historiquement été confrontés. Il n’est donc pas possible de tenir compte des conditions historiques d’acclimatation au CO2 des organismes marins utilisés dans les expériences. L’impact de ce facteur sur l’Effet de Déclin observé pourrait provenir d’une proportion croissante d’études utilisant des poissons élevés en captivité dans des systèmes d’aquarium en recirculation avec des taux de CO2 élevés, par rapport aux poissons provenant de populations sauvages avec des taux de CO2 naturels. Il sera donc nécessaire à l’avenir de mieux connaître les taux de CO2 à la fois naturels et expérimentaux, c’est-à-dire de mieux contraindre la chimie des carbonates (Riebesell et al., 2011).
3.2. Les biais d’analyse dans un domaine en pleine maturation
Il est clair que le domaine de l’acidification des océans, et en fait la science en général, est sujet à de nombreux biais, y compris des biais méthodologiques et de publication (Browman, 2016). Ce qu’il faut retenir, c’est que si la science fonctionnait correctement dès le départ et que les premiers effets de l’acidification des océans sur le comportement des poissons étaient vrais, les relations présentées aux figures 2 et 3 présenteraient des lignes plates montrant des tailles d’effet cohérentes dans le temps. Il est également évident que l’Effet de Déclin découvert ici n’est pas explicable par les trois processus biologiques probables (décrits ci-dessus). Ainsi, les données présentées par Clements et al. (2022) constituent-elles un exemple typique d’un domaine nouveau et émergeant, celui d’un sujet d’actualité, susceptible d’être biaisé. Les auteurs ont donc évalué les rôles de trois biais potentiels : (1) les biais méthodologiques ; (2) les biais de publication sélective et (3) les biais de citation. Ils considèrent ensuite l’influence potentielle des auteurs/chercheurs dans l’évolution de l’Effet de Déclin.
3.3. Les biais méthodologiques.
Les approches méthodologiques des études individuelles, et les biais qu’elles comportent, peuvent contribuer à l’inflation précoce des tailles d’Effet. Ces biais peuvent prendre la forme de protocoles expérimentaux, de la conception expérimentale choisie et de la taille des échantillons, ainsi que de l’approche analytique/statistique employée. Les biais de l’expérimentateur peuvent également contribuer à gonfler les effets.
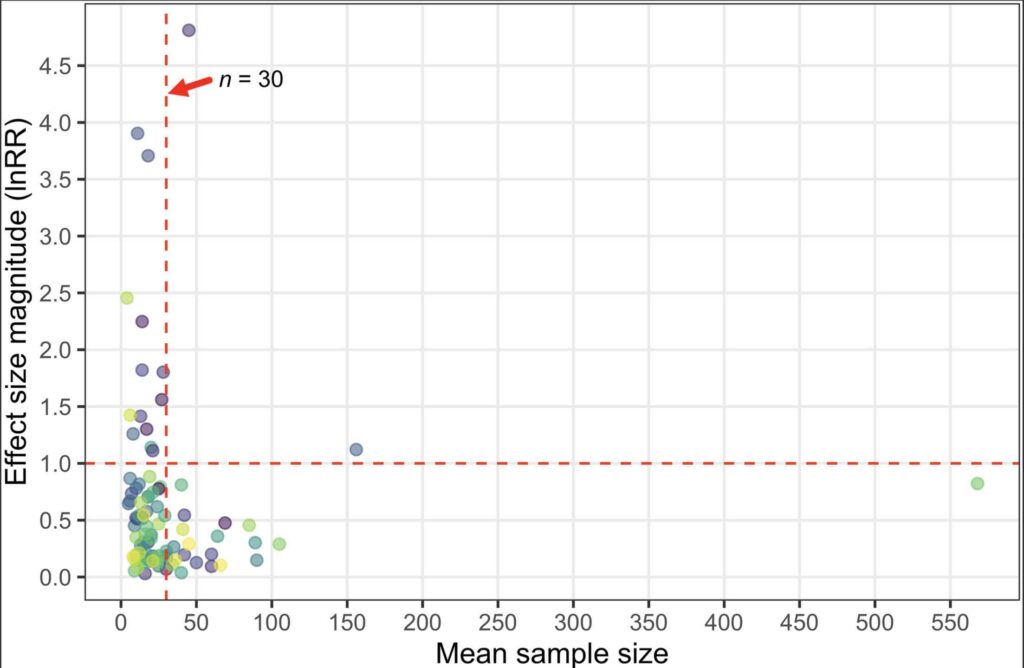
Les plans et protocoles expérimentaux peuvent introduire des biais non désirés pendant l’expérience, que les chercheurs s’en rendent compte ou non. Par exemple, les expériences portant sur des échantillons de petite taille sont plus sujettes aux erreurs statistiques, et les études portant sur des échantillons de grande taille devraient être plus fiables que celles portant sur des échantillons de petite taille (Columb et Atkinson, 2016) qui mènent à un résultat expérimental prédéterminé, ce qui peut contribuer à gonfler les Effets (Head et al., 2015). L’analyse de Clements et al. (2022) montre que la quasi-totalité des études (13 études sur 15 soit 87%) présentant les tailles d’Effet les plus importantes (Effet > 1,0) avaient des tailles d’échantillon moyennes (par traitement expérimental) inférieures à 30 poissons. (Figure 4). De même, le nombre d’études rapportant une taille d’effet >0,5 a fortement diminué après que la taille moyenne de l’échantillon ait dépassé 30 poissons (Figure 4). La taille de l’échantillon n’est bien sûr pas le seul attribut qui décrit la qualité d’une étude, mais les effets détectés suggèrent certainement que les études avec n < 30 poissons par traitement peuvent produire des effets fallacieux et devraient être pondérées en conséquence.
Le biais de l’expérimentateur/de l’observation pendant la collecte des données peut sérieusement fausser les résultats de la recherche comportementale (Marsh et al., 2007). La plupart des publications évaluant les effets de l’acidification des océans sur le comportement des poissons, y compris les premières études rapportant des tailles d’Effet importantes, ne sont pas des études randomisées réalisées en double aveugle. L’expérimentateur doit en effet réaliser ses expérience sans savoir s’il analyse un poisson dans de l’eau acidifiée ou non, sinon il peut influencer les résultats. Étant donné que les déclarations faites par les auteurs des études peuvent être trompeuses, un appel a également été lancé en faveur de preuves vidéo dans la recherche sur le comportement animal (Clark, 2017). De plus, la persistance d’Effets exagérés au-delà des études initiales peut être perpétuée par le biais de confirmation, car les études de suivi tentent à confirmer les Effets exagérés initiaux et de capitaliser sur la réceptivité des journaux à forte visibilité aux nouveaux phénomènes (apparents) (Duarte et al., 2015). Bien que l’analyse de Clements et al. (2022) ne démontre pas empiriquement que le biais de l’expérimentateur ait contribué à l’Effet de Déclin, il est possible que des biais conscients et inconscients de l’expérimentateur aient contribué à des tailles d’Effet importantes dans ce domaine.
3.4. Biais de publication et de citation.
Une autre explication importante de l’Effet de Déclin est le biais de publication sélectif, car les résultats montrant des Effets forts sont souvent publiés plus facilement, et dans des revues à fort impact, que les études montrant des résultats faibles ou nuls. Le biais de publication est sans doute l’explication la plus parcimonieuse de l’Effet de Déclin en écologie et en évolution, car les études ne montrant aucun Effet peuvent être difficiles à publier (Jennions et Moller, 2002). Cela peut être attribué au fait que les auteurs publient de manière sélective des résultats impressionnants dans des revues prestigieuses (et ne publient pas les résultats moins intéressants). Cette publication biaisée peut entraîner la prolifération d’études rapportant des effets forts, même s’ils ne sont pas forcément vrais et peut alimenter le biais de citation.
Pour déterminer si les études testant les effets de l’acidification des océans sur le comportement des poissons présentaient des signes de biais de publication et de citation, les relations entre l’ampleur de la taille de l’Effet, le facteur d’impact du journal et les citations Google Scholar peuvent être analysées en vue d’objectiver ce point (Figure 4 in Clements et al. 2022). Il en résulte que les Effets les plus frappants de l’acidification des océans sur le comportement des poissons ont effectivement été publiés dans des revues ayant un facteur d’impact élevé (Figure 4c in Clements et al. 2022). En outre, ces études ont eu une plus grande influence (c’est-à-dire une fréquence de citation plus élevée) sur ce domaine à ce jour que les études à faible impact avec des tailles d’effet plus faibles (Fig. 4d et 4e, in Clements et al. 2022). Des résultats similaires ont été signalés dans d’autres domaines de l’écologie et de l’évolution, notamment dans des études sur les réactions des plantes terrestres à un taux élevé de CO2 (Murtaugh 2002).
Dans l’ensemble, ces résultats suggèrent que les études évaluant les impacts de l’acidification sur le comportement des poissons ont généralement des tailles d’échantillon faibles, ont tendance à être publiées dans des revues à fort impact, et sont également plus citées. Par conséquent, la combinaison de la faible taille des échantillons et de la préférence pour la publication d’effets importants a apparemment conduit à une interprétation erronée selon laquelle l’acidification des océans aurait de vastes répercussions sur le comportement des poissons et donc des conséquences écologiques de grande ampleur – une interprétation qui persiste dans de nombreuses études publiées aujourd’hui (Tableau S2 in Clements et al. 2022).
3.5. Effets des chercheurs.
Il est important de noter que la validité scientifique des premières études publiées en 2009 et 2010 et de certains articles ultérieurs des mêmes auteurs, a récemment été remise en question (Ensering, 2021). En effet, ces premières études ont une grande influence sur l’Effet de déclin observé dans l’analyse de Clements et al. (2022). Lorsque tous les articles rédigés ou coécrits par au moins un des chercheurs principaux de ces premières études ont été retirés de l’ensemble des données (n = 41 études, 45 %), l’Effet de Déclin n’était plus apparent de 2012 à 2019 (Figure 5 in Clements et al. 2022). Pour les auteurs, les futures études documentant la présence ou l’absence d’Effets de Déclin – et d’ailleurs les méta-analyses en général – devraient soigneusement examiner et évaluer si des effets de chercheur peuvent être en jeu dans un domaine d’étude donné.
3.6. Comment se comporter au mieux?
Ces résultats suggèrent que les effets importants de l’acidification des océans sur le comportement des poissons étaient au moins en partie dus à des facteurs méthodologiques dans les premières études (par exemple, la faible taille des échantillons). En outre, la prolifération et la persistance de cette idée ont probablement été favorisés par la publication sélective de grandes tailles d’Effet par les auteurs et les revues, en particulier au début de ce domaine, et par la fréquence élevée et continue des citations de ces articles. Il est important de noter, cependant, que la faible taille de l’échantillon et la publication sélective ne peuvent pas expliquer entièrement le fort Effet de Déclin détecté, et que d’autres biais et processus peuvent être en jeu (Clark et al., 2020).
À cette fin, les auteurs préconisent que les futures études concernant l’acidification des océans et le comportement des poissons devraient utiliser un échantillon de plus de 30 poissons par traitement afin d’être considérées comme fiables. Il est de la responsabilité conjointe des chercheurs, des rédacteurs en chef et des évaluateurs de veiller à ce que les manuscrits soumis respectent cette directive. Pour ce faire, les auteurs doivent indiquer clairement la taille exacte des échantillons dans le texte des manuscrits, cependant, d’après l’analyse de Clements et al. (2022), 34% des études ne l’ont pas fait de manière adéquate (voir les données brutes dans S2 Data, ibid).
Enfin, le fait de faire preuve d’esprit critique et de scepticisme à l’égard des premiers résultats présentant des Effets importants peut contribuer à éviter bon nombre des problèmes du monde réel associés aux effets exagérés.Il est intéressant de noter qu’une étude récente a montré que les scientifiques expérimentés sont très précis lorsqu’il s’agit de prédire quelles études résisteront à une réplication indépendante par rapport à celles qui ne le feront pas, ce qui confirme l’idée que si quelque chose semble trop beau pour être vrai, c’est probablement le cas. Néanmoins, l’analyse des citations fournies ici suggère que les chercheurs ont été lents à adopter les études rapportant des résultats négatifs et nuls dans ce domaine, car les premières études présentant des effets importants restent les plus citées parmi tous les articles de notre ensemble de données. Plus tôt un scepticisme sain est appliqué, moins les résultats gonflés ont un impact important sur le processus scientifique et la perception des scientifiques par le public. En fin de compte, une réplication indépendante devrait toujours être établie avant que de nouveaux résultats ne soient promus à grande échelle.
4. REMARQUES FINALES
• Les résultats de l’article de Clements et al. (2022) démontrent que plus d’une décennie de recherche sur l’acidification des océans et le comportement des poissons est caractérisée par un Effet de Déclin. Bien que le domaine se situe actuellement dans une bonne approche en ce qui concerne les effets réels de l’acidification sur le comportement des poissons, il aura quand même fallu 10 ans pour y arriver. Malheureusement, certaines études actuelles continuent de citer des études antérieures réalisées avec des tailles d’échantillons déraisonnables, probablement pour promouvoir l’idée que l’acidification aura un large impact sur le comportement et l’écologie des poissons (voir par exemple, le tableau S2 in Clements et al. 2022). Ceci suggère qu’un changement de mentalité est encore nécessaire pour beaucoup dans ce domaine. Le chemin est donc long pour rétablir les faits (cf. les médias par exemple).
• Dans un sens plus large, ces données révèlent que l’Effet de Déclin mérite d’être exploré en ce qui concerne d’autres phénomènes biologiques et écologiques et un plus large éventail de disciplines scientifiques, en particulier en ce qui concerne les effets du changement global. L’exagération précoce des effets peut avoir des répercussions réelles sur le processus scientifique et sur les scientifiques eux-mêmes (Clements, 2020). Le respect des étapes décrites ici peut contribuer à atténuer ces répercussions, à parvenir plus rapidement à une véritable compréhension d’un phénomène et à progresser vers une reproductibilité accrue.
Addendum
La méthodologie de la recherche documentaire ou de la littérature consacrée au sujet est reprise en détail dans la dernière partie de l’article de Clements et al. (2022) et accompagnée d’un organigramme, de tableaux (S3 et S4) et de quelques graphiques.
Ci-dessous quelques articles soulignant l’effet d’exagération de l’acidification sur les organismes marins
• One New Coral Reef Study Wipes Out Four Climate Alarm Narratives In One Fell Swoop, 2022
• Fishy Business : Alleged Fraud over Ocean Acidification Research, Reversal on Coral Extinction, 2021,
• Does ocean acidification alter fish behaviour? Fraud allegation create a sea of doubt, 2021,
• Claim : Ocean acidification causing coral ‘osteoporosis’ on iconic reefs, 2020,
• Coral Reefs Thrive Near Acidic Waters (pH ± 6.0). Where Seafloor Vents Emit Up To 95,000 ppm CO2, 2020,
• No Evidence Ocean Acidification Harms Coral Reef Fish Behavior, 2020,
• Ocean acidification a big problem – but not for coral reef fish behaviour, 2020,
• Analysis Finds Ocean Have Become LESS ‘Acidic’ With Rising CO2, Challenging The ‘Acidification’ Narrative, 2019,
• Ocean Acidification Background Context, 2018,
• A Brachiopod’s Twelve-Decade response to Ocean Acidification and Warming, 2018,
• The Total Myth of Ocean Acidification, 2018.
Autres références avec le lien ici.

Il a fait parfois plus chaud dans le passé sous l’empire Romain ou au Moyen-Age et pourtant les coraux étaient en pleine forme au XXe siècle. La nature reprend ses droits beaucoup plus vite que les scientifiques ne le modélisent (si tant est que ce soit faisable). En d’autres termes, si une étude de court terme telle que celle développée dans l’article est intéressante, elle est « couverte » par les effets de plus terme. Par exemple quel est l’équilibre dans le temps entre l’acidification et la sédimentation des carbonates?
de plus long terme (avant-dernière phrase, pardon)
Une étude financée par le Ministère français de l’Environnement, de l’Energie et des Océans publiée en octobre 2018 (https://wires.onlinelibrary.wiley.com/doi/abs/10.1002/wcc.557) portant sur plus de 709 îles du Pacifique, incluant 30 atolls, montre qu’aucun de ces atolls n’a perdu en surface et que 88,8% des iles restèrent stables ou augmentèrent leurs surfaces respectives sur ces 20 dernières années, tandis que 11,4% seulement ont vu leur surface se réduire.
Ce qui tendrait à prouver que malgré la hausse prétendument « catastrophique » du niveau marin et l’acidification (en fait très modeste) des océans, les systèmes coralliens menacés de submersion par le réchauffement climatique réagissent avec une vigueur étonnante pour la compenser, et voire même au delà d’une simple compensation, accroitre les volumes de ces systèmes, d’une « extrême fragilité » si l’on en croit les écolocatastrophistes patentés toujours à l’affût de la dernière nouvelle « It’s worse than we thougt ».
Mais la « Grande Barrière » sur le point de disparaitre, c’est toujours très vendeur pour la plupart des média mainstream occidentaux…
Y compris en France où cette étude financée par l’argent public n’a eu AUCUN écho médiatique.
La science (enfin, une certaine science) exagère, la presse exagère, toute la gent réchauffiste exagère. L’océan serait foutu, ben tiens !
Lu dans Mediapart : « Alors que le GIEC vient d’achever la publication de son sixième rapport et que l’État a récemment été condamné deux fois par la justice pour carences fautives dans la lutte contre le réchauffement global, aucun territoire français n’est aujourd’hui épargné par les dérèglements climatiques. 101 départements composent l’Hexagone. 101 histoires qui montrent la réalité du chaos en cours dans notre pays ».
Rien que ça ! Mince alors, l’Etat « condamné pour carence » dans la lutte contre qqch qui n’existe pas ou qui est tellement minime que la faute à l’homme (CO2) reste à démontrer (quantité de données dispo sur internet sur le sujet).
« Chaos en cours dans le pays »… Vous avez vu un chaos, vous, à part dans qq cervelles, elle vraiment surchauffées ?
La sécheresse guette en France ce printemps. Ce sera à coup sûr pour très bientôt l’évidence trompettée de ce terrible DEREGLEMENT.
Cependant, le passé récent regorge d’événements plus extraordinaires (sans ce fichu CO2).
Petit rappel pour les incultes :
Episodes cévenols : 792 mm de pluie en 21 heures à Joyeuse (crue de l’Ardèche du 9 octobre 1827), 971 mm (presque un mètre) à Montpezat (Ardèche) en 5 jours (du 19 au 23 septembre 1890), 950 mm en 24 heures à Valleraugue (crue du Tarn du 28 et 29 septembre 1900), 1 000 mm en 24 heures et 1 930 mm en 5 jours à Saint-Laurent-de-Cerdans (crue du Tech, Roussillon, du 16 au 21 octobre 1940), 687 mm en 21 heures à Anduze (crue des Gardons du 8 et 9 septembre 2002). D’après Lang & Cœur (2014).
Canicules, sécheresses : selon le Dr Fuster (livre publié en 1848), « La sécheresse de 357 permit de passer le Rhin à gué. En 584, les roses fleurirent au mois de janvier. Les arbres qui avaient porté des fruits en juillet en portèrent de nouveau en septembre. En 921, il y eut une chaleur intense et une sécheresse extrême presque sans interruption pendant les mois de juillet, août et septembre, détruisant beaucoup de récoltes. L’été 1078 fut très chaud au point qu’on vendangeât abondamment au moins d’août. Les chaleurs intenses de 1183 et 1188 tarirent les fleuves et les puits. En 1325, la sécheresse fut telle qu’on ne comptait à peine la valeur de deux jours de pluie sur quatre mois. En 1384, une chaleur sèche et insupportable régna dans toute la France depuis le printemps jusqu’au milieu du mois d’août. La sécheresse de 1632 dura depuis le 12 juillet jusqu’au 15 septembre. Aux Pays-Bas, l’armée de Louis XIV pouvait passer les fleuves à gué, le 5 juin 1672, l’année de toutes les catastrophes en ce pays ».
D’autres : la sécheresse de 1876-1879 a fait 16 millions de morts et a touché pratiquement le monde entier. En Australie 10 millions de moutons sont morts. Plus proche de nous, en l’espace de 3 mois en 1911, une vague de chaleur fit 40 000 morts en France. Dans l’immédiat après-guerre, les années 1945, 1947, 1949, 1950 et 1952 ont été très chaudes. Le 28 juillet 1947 les 40,4 °C sont atteints.
Même lors du Petit Âge de Glace (fin du règne de Louis XIV), des étés très chauds ont été enregistrés (cf ci-dessus), preuve que le climat est erratique et que les tendances long terme sont difficiles à mettre en évidence.
Mais tout ça est oublié. La grande peur du deuxième millénaire arrive, avec un peu de retard mais elle arrive, au moins dans le monde dit occidental qui, à l’évidence, aurait bien besoin d’un psy, d’un peu plus de sens critique et surtout de lire davantage.
Faites circuler SVP la pétition de l’ACR pour stopper le lavage de cerveau, cela devient tragique !
«700 000 morts lors des canicules de 1718-1719», selon E.Leroy-Ladurie, cité par Libé:
https://www.liberation.fr/france/2003/08/14/700-000-morts-lors-des-canicules-de-1718-1719_442098/
En plein Petit Age Glaciaire, faut-il le préciser ?
Les désordres économiques graves provoqués par les deux crises successives en cours, sanitaire à l’échelle mondiale d’abord et militairement conflictuelle en Europe vont avoir des conséquences énormes, incalculables, qui vont rendre la question climatique très, très secondaire, voire purement académique: A toute chose malheur est bon.
Le journal « The Guardian » qui se lamente du peu d’écho médiatique du n plus unième « dernier avertissement avant la catastrophe climatique imminente » émis en l’espace de 25 ans par le GIEC est très révélateur à cet égard.
https://wattsupwiththat.com/2022/04/04/guardian-media-barely-reporting-un-climate-catastrophe-warnings/
https://wattsupwiththat.com/2022/04/04/guardian-media-barely-reporting-un-climate-catastrophe-warnings/
Quand on veut instrumentaliser la science au nom d’une idéologie…
En tant que professeur d’université spécialiste de la chimie des solutions, je voudrais donner mon avis sur un point particulier souvent invoqué pour démontrer les dégâts causés par le supposé réchauffement climatique d’origine anthropique : l’acidification de l’eau de mer par l’absorption de CO2, qui provoquerait la mort des coraux et la disparition progressive de la flore et de la faune sous-marines. Il est affirmé par le GIEC que la mer devient « plus acide » avec une « augmentation de l’acidité de 20 ou même 26 % » ! Chiffres peut-être corrects, sauf que : d’après Wikipedia, le pH des eaux de mer serait compris entre 7,4 et 8,6, avec une moyenne de 8,2 ; d’après le GIEC, il aurait baissé entre 1751 et 2004 de 0,1 unité (toujours cité dans Wikipedia) (NdA : comment peut-on le savoir, alors qu’en 1751, et même bien des décennies plus tard encore, la notion de pH était évidemment inconnue ?). 0,1 unité de pH correspond à une variation de 20 % de la concentration des ions H+ « libres » en solution, c’est-à-dire des ions H3O+ (d’après la forme logarithmique de la définition du pH : dpH = 0,1, d’où dcH+ = 10-0,1 = 0,21). Mais, à ce pH moyen actuel de 8,1, correspondant à une concentration des ions H+ libres de d’environ 10-8 mole/l, c’est-à-dire infime, l’eau de mer est toujours aussi faiblement basique (pH > 7, la valeur de la neutralité de l’eau pure). C’est-à-dire que, malgré l’apport de CO2, l’eau de mer n’est jamais acide, le pH étant fixé par le système acide-base HCO3-/CO32- : le CO2 qui se dissout réagit sur les ions carbonate en formant un peu plus d’hydrogénocarbonate. Au pH de 8,1, le calcul à partir de la loi d’équilibre en solution (faute de connaître les variations de pKa entre les solutions diluées et les solutions salines concentrées, ce sont les valeurs dans les premières qui ont été utilisées pour effectuer ce calcul) montre que la concentration des molécules CO2 en solution (CO2 hydraté, que l’on écrit souvent H2CO3, inutilement car cette molécule n’a pas d’existence réelle) est de l’ordre de 2 % de celle des ions hydrogénocarbonate. D’après Wikipedia, cette dernière est égale à 1,8.10-3 mole/kg dans l’eau de mer, ce qui donne pour le gaz carbonique dissous moins de 3,6.10-5 mole/kg, moins de 0,00016 % en poids.
L’augmentation de la température maritime fait baisser la solubilité de CO2 dans l’eau, donc doit entraîner une augmentation du pH ; mais en même temps, si la pression partielle de CO2 dans l’atmosphère croît, la solubilité augmente, entraînant une diminution du pH. La faible variation constatée de cette grandeur semble montrer que les deux effets se contrebalancent sensiblement.
Une telle variation de pH — pas plus de 0,1 unité — met-elle vraiment en péril la faune et la flore sous-marines ? Mais, affirmer que l’acidité de la mer augmente de 26 % est, pour le commun des mortels pour qui un acide, c’est extrêmement dangereux, bien plus effrayant que de seulement dire que la basicité a légèrement diminué ; et 26 % d’augmentation de l’acidité effraie bien plus que la diminution de 0,13 unité de pH à laquelle ceci correspond. De plus, si le pH peut varier naturellement dans un intervalle de ± 0,6 unité, une variation de 0,1 unité peut-elle être significative ? (Où a-t-elle été mesurée, et quels sont les intervalles d’incertitude ?).
Une autre remarque : 0,1 unité de pH n’est pas statistiquement significatif, car c’est de l’ordre de l’incertitude sur les mesures de pH à l’aide d’électrodes de verre (en outre, pas les mêmes électrodes selon l’endroit et l’époque). Pour la même électrode, c’est déjà 0,05 unité (écart-type) dans le cas de solutions diluées, en laboratoire, mais certainement plus dans les conditions d’utilisation dans l’eau des océans. En outre se pose la question de l’étalonnage des électrodes avec des solutions de pH connus (donc, dans le cas des mesures évoquées ici, entraînant certainement des erreurs systématiques en plus des erreurs aléatoires). Bref, tout cela me conduit à conclure que, tant que « l’acidification » se limitera à d’aussi faibles écarts de pH, pas trop d’inquiétude à avoir : l’acidification reste inappréciable et retire un argument pourtant largement agité pour preuve du réchauffement climatique dû au gaz carbonique.
merci pour ces précisions.